Взаимозаменяемость однотипных тканей разных людей называется гистосовместимостью (от греч. hystos — ткань).
Гистосовместимость важна в первую очередь для пересадки органов и тканей другому человеку. Простейший пример — переливание крови, для которого нужно совпадение донора крови и реципиента (получателя) по системе AB0 и резус-фактору. Первоначально (в 1950-е годы) для пересадки органов ориентировались только на совместимость по эритроцитарным антигенам АВ0 и Rh. Это несколько улучшало выживаемость, но все равно давало слабые результаты. Перед учеными встала задача придумать что-то более действенное.
Что такое MHC и HLA
Чтобы избежать отторжения пересаженной ткани, органа или даже красного костного мозга, ученые стали разрабатывать систему генетического сходства у позвоночных животных и человека. Она получила общее название — Главный комплекс гистосовместимости (англ. MHC, Major Histocompatibility Complex).
Обратите внимание, что MHC является главным комплексом гистосовместимости, то есть он не единственный! Есть и другие системы, значимые для трансплантологии. Но в медвузах их практически не изучают.
Поскольку реакции отторжения осуществляются иммунной системой, то Главный комплекс гистосовместимости напрямую связан с клетками имунной системы, то есть с лейкоцитами. У человека главный комплекс гистосовместимости исторически называется Человеческим лейкоцитарным антигеном (обычно везде используется английское сокращение — HLA, от Human Leucocyte Antigen) и кодируется генами, расположенными в 6-й хромосоме.
Напомню, что антигеном называется химическое соединение (обычно белковой природы), которое способно вызывать реакцию иммунной системы (образование антител и др.), ранее я уже более подробно писал об антигенах и антителах.
Система HLA представляет собой индивидуальный набор различного типа белковых молекул, находящихся на поверхности клеток. Набор антигенов (HLA-статус) уникален для каждого человека.
К первому классу МНС относятся молекулы типов HLA-A, -B и -C. Антигены первого класса системы HLA находятся на поверхности ЛЮБЫХ клеток. Для гена HLA-А известны около 60 вариантов, для HLA-B — 136, а для гена HLA-С — 38 разновидностей.
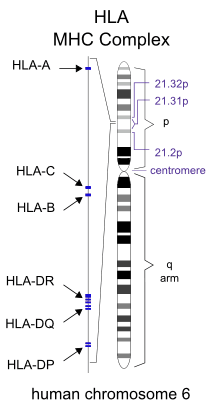
Расположение генов HLA в 6 хромосоме.
Источник рисунка: http://ru.wikipedia.org/wiki/Человеческий_лейкоцитарный_антиген
Представителями МНС второго класса являются HLA-DQ, -DP и -DR. Антигены второго класса системы HLA находятся на поверхности только некоторых клеток ИМУННОЙ системы (в основном это лимфоциты и макрофаги). Для транплантации ключевое значение имеет полная совместимость по HLA-DR (по другим HLA-антигенам отсутствие совместимости менее значимо).
HLA-типирование
Из школьной биологии надо помнить, что каждый белок в организме кодируется каким-либо геном в хромосомах, поэтому каждому белку-антигену системы HLA соответствует свой ген в геноме (наборе всех генов организма).
HLA-типирование — это выявление разновидностей HLA у обследуемого. У нас есть 2 способа определения (типирования) интересующих нас антигенов HLA:
1) с помощью стандартных антител по их реакции «антиген-антитело» (серологический метод, от лат. serum — сыворотка). С помощью серологического метода мы ищем белок-антиген HLA. HLA-антигены I класса для удобства определяют на поверхности Т-лимфоцитов, II класса — на поверхности В-лимфоцитов (лимфоцитотоксический тест).
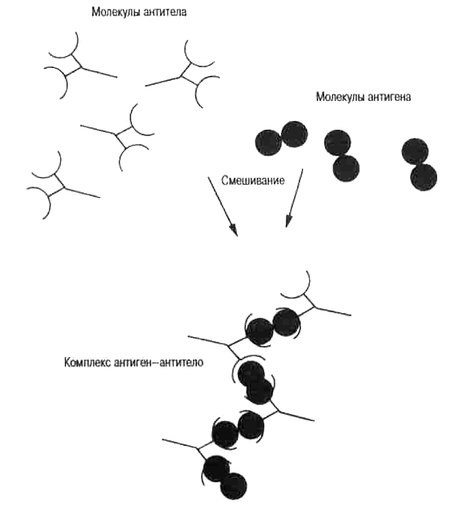
Схематическое изображение антигенов, антител и их реакции.
Источник рисунка: http://evolbiol.ru/lamarck3.htm
Серологический метод имеет много недостатков:
- нужна кровь обследуемого человека для выделения лимфоцитов,
- некоторые гены неактивны и не имеют соответствующих белков,
- возможны перекрестные реакции с похожими антигенами,
- искомые HLA-антигены могут быть в слишком низкой концентрации в организме или же слабо реагировать с антителами.
2) с помощью молекулярно-генетического метода — ПЦР (полимеразной цепной реакции). Мы ищем участок ДНК, который кодирует нужный нам антиген HLA. Для этого метода годится любая клетка организма, имеющая ядро. Зачастую достаточно взять соскоб со слизистой оболочки рта.
Наиболее точным является именно второй метод — ПЦР (оказалось, что некоторые гены системы HLA можно выявить только молекулярно-генетическим методом). HLA-типирование одной пары генов стоит 1-2 тыс. рос. рублей. При это сравнивают имеющийся вариант гена у пациента с контрольным вариантом этого гена в лаборатории. Ответ может быть положительным (совпадение найдено, гены идентичны) или отрицательным (гены разные). Для точного выяснения номера аллельного варианта обследуемого гена может понадобиться перебрать все возможные варианты (если помните, то для HLA-B их 136). Однако на практике никто не проверяет все аллельные варианты интересующего гена, достаточно подтвердить наличие или отсутствие только одного или нескольких наиболее значимых.
Итак, молекулярная система HLA (Human Leucocyte Antigens) кодируется в ДНК короткого плеча 6-й хромосомы. Там находится информация о белках, расположенных на клеточных мембранах и предназначенных для распознавания своих и чужеродных (микробных, вирусных и др.) антигенов и для координации клеток иммуннитета. Таким образом, чем больше сходства между двумя людьми по системе HLA, тем больше вероятность долгосрочного успеха при пересадке органа или ткани (идеальный случай — пересадка от однояйцевого близнеца). Однако изначальный биологический смысл системы MHC (HLA) состоит не в иммунологическом отторжении пересаженных органов, а заключается в обеспечении передачи белковых антигенов для распознавания различными разновидностями Т-лимфоцитов, ответственных за поддержание всех видов иммунитета. Определение HLA-варианта называется типированием.
В каких случаях проводят HLA-типирование?
Это обследование не является рутинным (массовым) и выполняется для диагностики только в сложных случаях:
- оценка риска развития ряда заболеваний с известной генетической предрасположенностью,
- выяснение причин бесплодия, невынашивания беременности (привычных выкидышей), иммунологической несовместимости.
HLA-B27
Типирование на HLA-B27 является, пожалуй, самым известным из всех. Этот антиген относится к MHC-I (молекулам главного комплекса гистосовместимости 1-го класса), то есть находится на поверхности всех клеток.
Согласно одной из теорий, молекула HLA–B27 хранит на себе и передает T-лифоцитам микробные пептиды (белковые микрочастицы), вызывающие артрит (воспаление суставов), что приводит к аутоиммунному ответу.
Молекула В27 способна участвовать в аутоиммунном процессе, направленном против собственных тканей организма, богатых коллагеном или протеогликанами (соединение белков с углеводами). Аутоиммунный процесс запускается бактериальной инфекцией. Наиболее частые бактериальные возбудители таковы:
- клебсиелла пневмонии,
- бактерии кишечной группы: сальмонелла, иерсиния, шигелла,
- хламидия (Chlamidia trachomatis).
У здоровых европейцев антиген HLA-B27 встречается всего в 8% случаев. Однако его наличие резко увеличивает (до 20-30%) шансы заболеть ассиметричным олигоартритом (воспаление нескольких суставов) и (или) получить поражение крестцово-подвздошного сочленения (воспаление соединения между крестцом и тазовыми костями).
Установлено, что HLA-B27 встречается:
- у больных анкилозирующим спондилоартритом (болезнью Бехтерева) в 90-95% случаев (это воспаление межпозвонковых суставов с последующим сращением позвонков),
- при реактивных (вторичных) артритах в 36-100% (аутоиммунно-аллергическое воспаление суставов после некоторых мочеполовых и кишечных инфекций),
- при болезни (синдроме) Рейтера в 70-85% (является разновидностью реактивного артрита и проявляется триадой, состоящей из артрита + воспаления мочевыводящего канала + воспаления слизистой оболочки глаз),
- при псориатическом артрите в 54% (артрит при псориазе),
- при энтеропатических артритах в 50% (артриты, связанные с поражением кишечника).
Если антиген HLA-B27 не обнаружен, болезнь Бехтерева и синдром Рейтера маловероятны, но в сложных случаях полностью исключить их все равно нельзя.
Если же у вас присутствует HLA-B27, советую вовремя лечить бактериальные кишечные инфекции и избегать половых инфекций (особенно хламидиоза), иначе с высокой вероятностью придется стать пациентом ревматолога и лечить воспаление суставов.
HLA-типирование для оценки риска сахарного диабета
Определенные разновидности HLA-антигенов чаще остальных встречаются у больных сахарным диабетом, а другие HLA-антигены — реже. Ученые пришли к выводу, что некоторые аллели (варианты одного гена) могут обладать провоцирующим или защитным действием при сахарном диабете. Например, наличие B8 или B15 в генотипе по отдельности увеличивает риск диабета в 2-3 раза, а совместно — в 10 раз. Присутствие определенных разновидностей генов может увеличивать риск заболевания сахарным диабетом 1 типа с 0,4% до 6-8%.
Счастливые носители B7 болеют диабетом в 14,5 раз реже тех людей, у которых B7 отсутствует. «Защитные» аллели в генотипе также способствуют более мягкому течению болезни в случае, если диабет все-таки разовьется (например, DQB*0602 у 6% больных СД 1 типа).
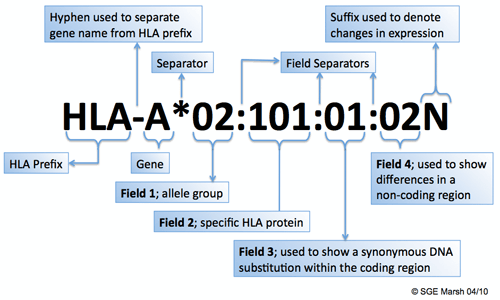
Правила наименования генов в системе HLA:
HLA-ген*{аллельная группа}:{специфический HLA-белок}:{показывает похожие замены в ДНК в кодирующем регионе}:{показывает отличия в некодирующем регионе}{буква N отражает изменения в экспрессии гена}.
Экспрессия гена — это процесс использования генетической информации, при котором информация из ДНК превращается в РНК или белок.
HLA-типирование позволяет установить риск развития сахарного диабета 1 типа. Наиболее информативны антигены HLA II класса: DR3/DR4 и DQ. У 50% больных СД I типа обнаружены HLA-антигены DR4, DQB*0302 и/или DR3, DQB*0201. При этом риск развития болезни возрастает многократно.
(дополнение от 30 мая 2015)
HLA-антигены и невынашивание беременности
В комментариях здесь спросили:
У нас с мужем полное совпадение (6 из 6) по HLA второго типа. Есть ли способы бороться с невынашиванием беременности в таких случаях? К кому нужно обращаться, иммунологу?
Одним из иммунологических факторов невынашивания беременности является совпадение по 3 и более общим антигенам HLA II класса. Напомню, антигены HLA II класса находятся преимущественно на клетках иммунной системы (лейкоциты, моноциты, макрофаги, эпителиальные клетки). Ребенок получает половину генов от отца и половину от матери. Для иммунной системы любые белки, кодируемые генами, являются антигенами и потенциально способны вызывать иммунный ответ. В начале беременности (первый триместр) чужеродные для организма матери отцовские антигены плода вызывают у матери выработку защитных (блокирующих) антител. Эти защитные антитела связываются с отцовскими HLA-антигенами плода, защищая их от клеток иммунной системы матери (натуральных киллеров) и способствуя нормальному протеканию беременности.
Если же у родителей совпадает 4 и более антигена HLA II класса, то образование защитных антител резко снижается или не происходит. В этом случае развивающийся плод остается беззащитным от материнской иммунной системы, которая без защитных антител расценивает клетки эмбриона как скопление опухолевых клеток и старается их уничтожить (это естественный процесс, потому что в любом организме ежесуточно образуются опухолевые клетки, которые ликвидируются иммунной системой). В итоге наступает отторжение эмбриона и выкидыш. Таким образом, для для нормального протекания беременности нужно, чтобы супруги отличались HLA-антигенами II класса. Также существует статистика, какие аллели (варианты) HLA-генов женщин и мужчин приводят к выкидышам чаще или реже.
Как лечить?
- Перед планируемой беременностью требуется вылечить инфекционно-воспалительные процессы у супругов, потому что наличие инфекции и воспаления активирует иммунную систему.
- В первой фазе менструального цикла (на 5-8 день) за 2-3 месяца до планируемого зачатия или программы ЭКО проводят лимфоцитоиммунотерапию (ЛИТ) лимфоцитами мужа (подкожно вводят лейкоциты отца будущего ребенка). Если муж болен гепатитом или другими вирусными инфекциями, используют донорские лимфоциты. Лимфоцитоиммунотерапия наиболее эффективна при наличии 4 и более совпадений по системе HLA и повышает шанс успешной беременности в 3-4 раза.
- Во второй фазе цикла (с 16 по 25 день) проводят лечение гормоном дидрогестероном.
- На ранних этапах беременности используют методы активной и пассивной иммунизации: лимфоцитоиммунотерапию каждые 3-4 недели до 12-14 недель беременности и внутривенное капельное введением средних доз иммуноглобулина (15 г в первом триместре). Это мероприятия способствуют успешному протеканию I триместра и снижают риск формирования плацентарной недостаточности.
Таким образом, лечение иммунологического невынашивания беременности должно проходить только в специализированном учреждении (центр невынашивания беременности, отделение патологии беременных и др.) под контролем штатного гинеколога, иммунолога, эндокринолога (гинеколога-эндокринолога). Обращаю внимание, что рядовые гинекологи и иммунологи из других медучреждений могут не иметь достаточной квалификации в этой области.
Ответ подготовлен на основе материала сайта http://bono-esse.ru/blizzard/Aku/AFS/abort_hla.html
P.S. (дополнение от 11 августа 2015)
Понятие женского иммунологического бесплодия сейчас подвергается сомнению, оно остается предметом научных споров и не рекомендуется к использованию в клинической практике. Подробнее см. комментарии ниже.
Читайте также: исследования ДНК в Минске: Лаборатория генетики человека.
 molodnews.ru
molodnews.ru
У меня много лет болят суставы, особенно на ногах, Последние годы вообще не могу толком ходить. Но все врачи из года в год говорят только одно: «Ну и что? У всех пожилых ноги болят. У нас тоже! Худеть надо!» Тем самым подозревают меня в излишнем нытье. И никто не посоветовал мне сдать кровь на HLA-B27! Я сама, занимаясь самолечением, сдала его платно и результат положительный. Теперь только врачи сочувственно замолчали! Безобразие! Что за медицина у нас???
Я прочла эту статью и теперь хочу понять, где правда?
letidor.ru/article/hla_tri_zagadochnye_bukvy_30522/
HLA и бесплодие
Особенно популярно HLA-типирование в контексте «иммунологического бесплодия». Это и не удивительно, вопрос репродуктивной функции, реализации себя как родителя — очень важный и всегда глубоко эмоциональный. А значит, можно легко сыграть (и заработать) на этом. Есть данные, что от 10 до 36% беременностей прерываются спонтанно на ранних сроках у здоровых женщин в возрасте до 35 лет и после 42 соответственно. Если же беременность после ЭКО, то вероятность неудач еще выше. То есть, если прервалась одна или даже две подряд беременности, вне зависимости от их происхождения, — это не повод искать проблему. Тем более, это не повод говорить о «несовместимости» супругов.
Каково же происхождение этой теории? Исследования на экспериментальных животных в 60-х годах показали, что при спаривании сперматозоиды чаще соединяются с яйцеклеткой при выраженных различиях аллелей генов тканевой совместимости (HLA). В 70-х было обнаружено наличие антигенов HLA на поверхности сперматозоидов человека. Возникло предположение, что часть прервавшихся беременностей у человека связана с близкой гистосовместимостью супругов и были предложены терапевтические методы иммуномодуляции. Наиболее популярным подходом было переливание отмытых лимфоцитов мужа или донора до предполагаемой беременности или же, как вариант пассивной иммунизации, — внутривенное введение иммунноглобулинов (IVIG) в течение беременности.
На протяжении нескольких десятилетий европейские и американские врачи не просто следовали этим теориям, но обобщали свои результаты согласно правилам клинических исследований. Крупнейший мета-анализ 90-х годов (Ober C, et al. 1999) расставил все точки над i: это исследование включало 183 пациентки, было рандомизированным, проспективным, двойным слепым и многоцентровым (все условия достоверности!). Результат оказался потрясающим — в группе контроля, т.е. там где женщинам вводилось плацебо, эффективность «лечения» составила 48%, а в группе, получавших иммунотерапию — всего 36%. То есть, теория однозначно не подтвердилась.
На сегодня ведущие мировые рекомендации, основанные на доказательствах, гласят: «HLA — типирование, выявление цитотоксических антител против антигенов мужа и иммунотерапия не могут быть рекомендованы для обследования супружеских пар с невынашиванием беременности».
Это и понятно, учитывая то количество аллельных форм HLA-комплекса, о котором нам известно теперь. Реальное количество прервавшихся беременностей по иммунологической причине очень и очень мало. И даже если такой случай и был (хотя достоверно доказать его просто не возможно), это не является правилом для каждой беременности у данной пары. Поскольку вариантов комбинаций аллелей чрезвычайно много! И у следующего ребенка такая комбинация может быть даже очень благоприятной.
Так что, грустно наблюдать, как процветают не оправдавшиеся теории. И особенно если учесть, на основании каких анализов делают грандиозные выводы про HLA-совпадения. Практически невозможно провести полное HLA-генотипирование супругов, поскольку объем исследования был бы колоссален. Результаты, которые выдают в лабораториях, является очень приблизительным и очень усеченным вариантом типирования. Оценка совпадений генотипов супругов по таким результатам равноценна гаданию на кофейной гуще. И ладно бы ограничится громкой теорией про причину невынашивания, но главная опасность лишних анализов — лишнее псевдотерапевтическое вмешательство.
К началу 2000-х были детально проанализированы все иммунологические теории невынашивания и разные методы их коррекции. Вот окончательный вывод, основанный на многочисленных статистически достоверных исследованиях:
«Ни иммунизация лейкоцитами мужа, ни внутривенное введение иммуноглобулинов не увеличивает частоту родов у женщин с необъяснимыми повторными выкидышами. Такое лечение является дорогостоящими и имеет потенциально опасные побочные эффекты. Недопустимо подвергать женщин дополнительному чувству утраты, связанному с ложными ожиданиями от неэффективного лечения. Кроме того, лабораторные тесты, которые направлены на выявление показаний к иммунотерапии не имеют прогностического значения для исходов беременности и не должны применяться».
Давайте же прислушаемся к выводам, полученным тяжелым опытом других. Не будем наступать на те же грабли.
Комментарий автора сайта: